Лечение синдрома гипоплазии левых отделов сердца (сглос). Синдром гиполазии левого отдела сердца — серьезное заболевание с возможностью коррекции Гипоплазии левого сердца до скольки доживают
Федоров Леонид Григорьевич
Синдром гипоплазии левых отделов сердца является опасной патологией. Она возникает еще во внутриутробном периоде. В этом состоянии сердце недостаточно сформировано, из-за чего нормальное кровообращение невозможно. Органы и ткани страдают от недостаточного поступления крови, и новорожденный гибнет в течение первых дней жизни. Но, если успеют провести хирургическую коррекцию аномалии, ребенок может выжить. Сделать это должны в течение первых недель жизни.
Что это за проблема
Для синдрома характерна недостаточность в развитии левой части органа. Также с отклонениями и восходящая часть аорты. Сопутствует патологии сужение сердечных клапанов, что еще больше усугубляет ситуацию.
Заболевание выявляют у четырех процентов детей, рожденных с .
Из-за чего возникает
Отклонение возникает в процессе формирования органов плода. Точные причины порока ученым выяснить, еще не удалось.
Риск развития проблемы повышается, если на организм женщины в период вынашивания ребенка влияют негативные факторы. Это может произойти:
- если будущая мать употребляет спиртосодержащие напитки и наркотики;
- если организм попал под воздействие ионизирующего излучения;
- под влиянием употребления некоторых медикаментов;
- после перенесенных инфекционных процессов, среди которых грипп, краснуха;
- в результате проживания в неблагоприятных экологических условиях.
Немалую роль в формировании патологического состояния отводят наследственной предрасположенности.
Классификация
Протекать патологический процесс может в нескольких вариантах:
- СГЛОС или гипоплазия левых отделов сердца и атрезия устья аорты.
- В сочетании со стенозом и гипоплазией устья аорты.
Каждый случай представляет серьезную опасность для жизни малыша.
Гемодинамика
После того как ребенок появился на свет, врачи могут обнаружить, что процесс кровообращения нарушен. Это патологическое состояние развивается в ускоренном темпе и сопровождается тяжелыми изменениями в функционировании органов и систем.
 Такое состояние связано с тем, что поступление крови или левого предсердия в недостаточно развитый желудочек становится невозможным. Поэтому происходит проникновение крови в правые полости органа. В этом участке она смешивается с кровью из венозных сосудов.
Такое состояние связано с тем, что поступление крови или левого предсердия в недостаточно развитый желудочек становится невозможным. Поэтому происходит проникновение крови в правые полости органа. В этом участке она смешивается с кровью из венозных сосудов.
Под влиянием этого процесса правые отделы перегружаются и дилатируются.
После того как кровь смешалась, большая ее часть попадает в полость легочной артерии. Все остальное через попадает в аорту и большой круг кровотока. В результате этого недостаточно насыщенная кислородом кровь распространяется по организму.
В этой ситуации наблюдается чрезмерная нагрузка на правые отделы сердца, так как они должны обеспечить достаточный ток крови по обоим кругам кровообращения.
Сколько проживет ребенок, зависит от того, как долго артериальный проток будет оставаться в открытом состоянии.
В результате тяжелых нарушений кровообращения постепенно развивается легочная гипертензия в выраженной форме, так как в сосудах малого круга кровотока повышается давление. По причине достаточного наполнения сосудов большого круга происходит развитие артериальной гипотонии.
Так как в полости левого желудочка смешивается кровь, также выявляют артериальную гипоксемию.
При патологии органы и ткани не получают необходимый кислород и питательные компоненты, что не позволяет им нормально выполнять свои функции.
Особенности проявлений
Синдром гипоплазии правых отделов сердца чаще всего диагностируют у детей, рожденных в срок. При данной патологии снижается приток крови к легким, из-за чего она не обогащается кислородом в достаточном количестве. Обычно отклонение протекает не в изолированной форме, а сочетается с другими нарушениями в развитии внутренних органов. При таком отклонении:

Сразу после родов наблюдают легкое посинение кожного покрова, но постепенно цианоз усиливается и сосредотачивается в нижней части тела. Ощущается снижение периферической пульсации в конечностях, и они холодные на ощупь.
Сердце не может полноценно работать с первых дней жизни. Это приводит к тому, что печень увеличивается, в определенных участках тела накапливается жидкость. Также уменьшается количество выведенной мочи, моча не поступает в мочевой пузырь, смещается кислотно-щелочной баланс в сторону повышения кислотности.
Возможен генетический синдром с гипоплазией мозолистого тела, развивается ишемия в сердечной мышце и тканях головного мозга.
Все эти патологические изменения представляют серьезную опасность для жизни ребенка. Очень часто новорожденного не успевают спасти.
Под синдромом гипоплазии левых отделов сердца понимают группу близких и взаимосвязанных аномалий развития сердца, характеризующихся недоразвитием левых его камер, атрезией или стенозом аортального и/или митрального отверстия и гипоплазией восходящей части аорты. Число таких аномалий достаточно велико, но результаты исследований последних лет позволили выделить синдром гипоплазии левых отделов сердца в четкую клинико-анатомическую единицу [Чернова М. П., 1983; Singha S. et al., 1968; Van Praagh R. et al., 1971; Moodie D. et al., 1972; Mohri H, 1979; Doty D., 1980; Norwood W. et al., 1980, 1981 ].
Трудность такого выделения заключается в том, что если за критерий порока берется гипоплазия левого желудочка, то в комплекс приходится включать все пороки, при которых левый желудочек может быть плохо развит (некоторые варианты тетрады Фалло, отхождение сосудов от правого желудочка и др.). Единственный желудочек (правый анатомически) с «выпускником» для аорты также можно рассматривать как крайний вариант этой аномалии. Если же взять за критерий аномалии отсутствие или резкое изменение одного из клапанных отверстий левого желудочка, то даже при атрезии митрального клапана с наличием достаточно большого ДМЖП левый желудочек может быть развит почти нормально. Однако эти разнообразные мнения отступают на второй план, когда речь идет о специфическом клиническом синдроме, который сопровождается совершенно четкой клиникой и гемодинамикой и требует определенных хирургических мер, направленных на ее улучшение.
Согласно последним представлениям, к синдрому гипоплазии левого сердца следует относить порок, включающий следующий комплекс аномалий сердца: 1) атрезию или стеноз устья аорты; 2) атрезию или стеноз митрального отверстия; 3) гипоплазию левого желудочка; 4) гипоплазию восходящей части аорты; 5) резкую дилатацию правых отделов и легочного ствола; 6) наличие широкого открытого артериального протока как доминантного пути кровоснабжения сосудов дуги и нисходящей части аорты.
Первое описание анатомической картины атрезии устья аорты в сочетании с гипоплазией левого желудочка принадлежит К. А. Раухфусу (1869). В 1952 г. М. Lev предложил объединить группу пороков с недоразвитием левых отделов в так называемый комплекс гипоплазии аортального тракта. J. Noonan, A. Nadas предложили термин «синдром гипоплазии левого сердца», который прочно закрепился в литературе. В нашей стране наиболее полно этот вопрос изучен М. П. Черновой (1983), обобщившей материалы ИССХ им. А. Н. Бакулева АМН СССР.
Частота.
Синдром гипоплазии левого сердца относится к часто встречающимся порокам, он занимает пятое место среди всех ВПС (после ДМЖП, ТМС, тетрады Фалло и ко-арктации аорты). По данным D. Fyler и соавт. (1980), синдром гипоплазии выявлен у 7,7% из 2381 новорожденного с пороком сердца (0,163 на 1000 рожденных живыми). По данным М. П. Черновой, синдром гипоплазии левого сердца обнаружен у 20,8% из 125 детей с ВПС, наблюдавшихся в детской клинической больнице № 1 Москвы. По мнению всех авторов, данный синдром является основной причиной смертности новорожденных и детей с ВПС в первые недели жизни (25%). У мальчиков порок встречается в 2 раза чаще, чем у девочек.
Патологическая анатомия.
При гипоплазии левых отделов сердца отмечают резкое расширение правого желудочка, от которого отходит огромный ствол легочной артерии. Верхушка сердца целиком образована правым желудочком. Левый желудочек находится на заднелевой поверхности, и его контуры как бы прилеплены в виде шапочки к задней поверхности межжелудочковой перегородки. Правое предсердие также значительно увеличено в объеме. Аорта находится в обычной позиции, но восходящая ее часть представляет собой узкий тяж диаметром 2−3 мм. У перехода в дугу просвет аорты расширяется, но сама она выглядит гипопластичной. Легочный ствол переходит в широкий ОАП, который продолжается в нисходящую часть аорты, равную ему по диаметру. Ветви легочной артерии расширены. При вскрытии полостей сердца отмечается резкое уменьшение полости левого желудочка. Стенки его утолщены, а размер полости вмещает всего 1−5 мл жидкости. Выход в аорту закрыт. Размеры левого предсердно-желудочкового отверстия, если оно открыто, резко уменьшены. Диаметр мит-рального клапана в 3−5 раз меньше трехстворчатого. Створки утолщены и изменены. Полость левого предсердия также уменьшена. Имеется открытое овальное окно диаметром от 0,1 до 0,5 см. Восходящая часть аорты представляет собой тяж с просветом 1−2 мм. Межжелудочковая перегородка интактна. Правые отделы резко расширены. Диаметр легочной артерии в 5−7 раз больше диаметра восходящей части аорты. Описанная картина характерна для крайней формы атрезии аорты с атрезией или резким стенозом мит-рального клапана. При наличии аортального стеноза с проходимым отверстием размеры левых камер и восходящей части аорты несколько больше, но остаются значительно гипоплазированными.
Гемодинамика.
Нарушения гемодинамики при синдроме гипоплазии левого сердца наступают уже на ранних стадиях развития плода. В отличие от нормы, когда кровь из полых вен частично проходит через открытое овальное окно в левые отделы и в большой круг кровообращения, при описываемом синдроме вся кровь поступает в правый желудочек и в легочный ствол. Этим объясняется объемная перегрузка правых отделов сердца с их дилатаци-ей, наблюдающаяся с момента рождения . После рождения состояние кровообращения можно охарактеризовать как гемодинамическую «катастрофу». Венозная кровь поступает из полых вен в правые отделы и легкие обычным путем. Но кровь из легких, поступающая в левое предсердие, может пройти только через открытое овальное окно в правые отделы. Здесь происходит смешение крови, которая затем вновь поступает в легочную артерию. Часть ее через широко открытый артериальный проток поступает в нисходящую часть аорты и в нижнюю половину тела, а другая часть-ретроградно в восходящую часть аорты и брахиоцефальные сосуды. Восходящая часть аорты функционирует как «общая коронарная артерия», так как аортальный клапан закрыт. Таким образом, правый желудочек функционирует как общий для большого и малого круга кровообращения, перекачивая смешанную кровь. В сосуды большого круга поступает кровь недонасыщенная кислородом в объеме, определенном величиной ОАП. В свою очередь сердце снабжается кровью из гипоплазиро-ванной аорты; объем крови зависит от величины просвета аорты.
Тяжелейшие нарушения гемодинамики сводятся к резкому застою крови в легких, высокому давлению в системе сосудов малого круга кровообращения, правом желудочке и предсердии, неадекватному снабжению кровью большого круга, которое выражается в низком артериальном давлении, неадекватной работе сердца вследствие сниженного коронарного кровотока. Артериальная гипоксемия является одним из компонентов нарушений гемодинамики, хотя ее степень может быть не резко выраженной из-за достаточного смещения крови в правом желудочке : 1) резкое сужение восходящей части аорты; 2) уменьшение конечно-диастолического размера левого желудочка до 0,4−0,9 см; 3) сужение диаметра устья аорты до 0,6 см и более; 4) увеличение конечно-диастолического размера правого желудочка в среднем до 2,5 см (2,3−3,2 см); 5) соотношение конечно-диастолических размеров левого и правого желудочков менее 0,6; 6) наличие грубых изменений митрального клапана.
Значение эхокардиографической диагностики при данном пороке трудно переоценить, так как состояние больных бывает настолько тяжелым, что проведение обычного внутри-сердечного исследования является для них жизненно опасной процедурой. Из 117 детей с синдромом гипоплазии левого сердца, наблюдавшихся в Детском госпитале Бостона (США), 39 погибли во время зондирования и еще 42 в течение двух дней после него .
Катетеризация сердца позволяет обнаружить сниженное насыщение крови кислородом в периферической артерии, большой сброс крови слева направо на уровне предсердий. Цифры насыщения крови кислородом в правом желудочке, легочной артерии и аорте одинаковы. Давление в правом желудочке и легочной артерии равно 75 мм рт. ст. и выше и значительно превышает цифры давления в плечевой артерии или нисходящей части аорты при их одновременной регистрации. Диастолическое давление в правом желудочке повышено. Отмечается градиент систолического давления в 10−15 мм рт. ст. при выходе катетера из нисходящей части аорты через ОАП в легочный ствол . Сам маневр прохождения зонда через ОАП может вызвать брадикардию и остановку сердца.
При ангиографическом исследовании выявляют резкую дилатацию правого желудочка, расширение легочного ствола и легочных артерий, а также одновременное контрасти-рование нисходящей части аорты через ОАП. Восходящая часть аорты в виде нитевидного образования контрастиру-ется ретроградно, после заполнения брахиоцефальных сосудов. Если контрастное вещество вводится в левое предсердие, то ангиокардиографическая картина повторяется: вначале заполняются правые отделы, затем проток и аорта. При наличии проходимого левого предсердно-же-лудочкового отверстия можно увидеть резко уменьшенную полость левого желудочка. Для исследования состояния восходящей части аорты и ее ветвей рекомендуют введение контрастного вещества через катетер в лучевой или пупочной артерии .
Диагностика и дифференциальная диагностика.
При синдроме гипоплазии левого сердца клиническая диагностика базируется на следующих признаках: быстром развитии признаков недостаточности кровообращения у новорожденного, кардиомегалии, умеренном цианозе, слабом периферическом пульсе, одышке и тахикардии. Данную патологию необходимо дифференцировать от внесердечных аномалий и нарушений ритма, которые могут вызвать критическое состояние (синдром острой дыхательной недостаточности, кровоизлияние в мозг или травма черепа, геморрагический диатез, сепсис, проксимальная суправентрикулярная тахикардия). Из пороков сердца, которые могут вызвать в первые дни жизни критическое состояние, следует исключить АДЛВ, ТМС, предуктальную коарктацию, критический изолированный стеноз аортального клапана, некоторые варианты ЕЖС.
Естественное течение и прогноз.
Быстро развивается критическое состояние, и дети погибают через несколько дней после рождения. По данным D. Fyler, 72% детей погибают в течение 1−й недели жизни, из них 38%−в первые 48 ч.
Продолжительность жизни зависит от конкретного варианта порока. При наличии умеренной степени гипоплазии левого желудочка со стенозом (а не атрезией) клапанных отверстий продолжительность жизни может увеличиваться до нескольких недель и месяцев. D. Moodie и соавт. (1972) описали наблюдение, в котором мальчик с атрезией аорты прожил до 3 1 /^ лет. Авторы объясняли такую продолжительность жизни наличием большого межпредсердного сообщения и ДМЖП. Однако при специальном изучении пато-логоанатомического материала S. Singha и М. П. Чернова не нашли корреляций между величиной открытого овального окна и продолжительностью жизни. Эта зависимость абсолютна. Прогноз любого варианта синдрома гипоплазии левого сердца плохой-97% больных погибают в течение первого года жизни. Непосредственной причиной смерти являются сердечная недостаточность, пневмония и гипок-сическое состояние.
Хирургическое лечение.
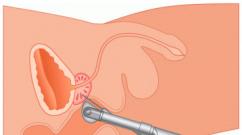
Многолетние и многочисленные попытки найти оптимальные способы паллиативного лечения или гемодинамической коррекции синдрома гипоплазии левых отделов сердца представляют сегодня лишь исторический интерес . Признанным и принятым методом лечения в настоящее время является этапный метод, разработанный W. Norwood, который является единственным в мире хирургом, в течение двух десятилетий систематически и творчески разрабатывающим данную сложнейшую проблему. Приводим краткое изложение принципов операции Норвуда .
Операция Норвуд I (первый-паллиативный-этап) . Выполняют срединную стернотомию, вскрывают перикард и проводят широкую мобилизацию аорты, дуги и ее ветвей, открытого артериального протока и легочного ствола. Канюлируют легочный ствол аортальной ка-нюлей и правое предсердие. Начинают перфузию с охлаждением пациента до температуры 18−20° С. Брахицефаличес-кие артерии пережимают турникетами. Останавливают перфузию и вскрывают правое предсердие. Иссекают всю межпредсердную перегородку.
Отсекают легочный ствол тотчас ниже бифуркации и отверстие закрывают заплатой.
Открытый артериальный проток отсекают от нисходящей аорты, проксимальный конец его перевязывают. Аорту рассекают вдоль всей доступной длины-от корня до нисходящего отдела. В образованный разрез вшивают выкроенный участок аортального или легочного гомотрансплантата для создания достаточно широкого просвета дуги и начала восходящей аорты. На этой стадии операции автор рекомендует наложение анастомоза между трансплантатом (нижней стенкой будущей дуги аорты) и бифуркацией легочной артерии с помощью протеза диаметром 5 мм. Данный этап заканчивают вшиванием отсеченного ранее легочного ствола в оставшееся (проксимальное) отверстие в аорте, расширенной гомотранс-плантатом, по типу конец в бок.
На следующем этапе возобновляют перфузию и согревают больного.
Операция Норвуд II (второй-корригирующий-этап . Операцию проводят через 12−18 мес после
первой. Подключают аппарат ИК, пережимают ранее наложенный аортолегочный анастомоз. Полностью, до корней легких, мобилизуют легочные артерии. Широко вскрывают правое предсердие и увеличивают, если нужно, межпред-сердное сообщение.
Рассекают продольно легочные ветви и в разрез вшивают заплату из гомотрансплантата для расширения ветвей.
С помощью заплаты фирмы «Гор-Текс» в полости правого предсердия создают тоннель для обеих полых вен (тотальный кавопульмональный анастомоз).
Верхнее отверстие тоннеля открывается в верхней части предсердия. Его анастомозируют с оставшимся отверстием в легочной артерии, которое ранее не закрывалось. Затем накрывают заплатой этот предсердно-легочный анастомоз, создавая для него «крышу».
Начиная с 1990 г., автор рекомендует разбить этот этап лечения на два. Вначале создают двунаправленный кавопульмональный анастомоз (так называемый геми-Фонтен), а затем, через несколько месяцев, производят окончательную гемодинамическую коррекцию по принципу Фонтена. Таким образом, операция Норвуд I преследует целью максимальное расширение гипоплазированных аорты и легочных артерий (по сути-создание двухкамерного сердца с атрезией легочного ствола и открытым артериальным протоком-«шунтом»). Операция Норвуд II направлена на полное разобщение кругов кровообращения с дальнейшей гемодинамикой, которая характерна для операций Фонтена.
Результаты.
С 1989 по 1992г. W. Norwood произвел операции 154 детям с синдромом гипоплазии левых отделов сердца. Первый этап (паллиативный) перенесли 104 ребенка, 78 больных выжили после второго (корригирующего) этапа, включая создание кавопульмонального анастомоза, 27 детей-после выполнения всех трех этапов. Необходимо подчеркнуть, что осуществление этих операций требует тщательной подготовки и слаженной работы всех служб, обеспечивающих диагностический, анестезиологический, хирургический и реанимационный этапы работы. Кроме того, немаловажное значение имеет концентрация больных с такой патологией в одном центре, в котором по мере накопления опыта результаты лечения постоянно улучшаются.
10084 0
Морфология
Патогенез этой группы аномалий недостаточно понятен. С одной стороны, гипоплазию левых структур сердца в экспериментах на животных можно получить, ограничив приток крови к этим отделам сердца, однако увеличение риска таких состояний у сибсов и других родственников предполагает наличие генетической основы. Сердце, как правило, расположено слева и увеличено за счет его вершины, сформированной ПЖ. ЛП маленькое с узким или заросшим предсердным отверстием. Отмечается тяжелый митральный стеноз или митральная атрезия. ЛЖ маленький и часто с крохотной восходящей аортой или с атрезией аорты. Трикуспидальный клапан, как правило, сформирован нормально, отмечается гипертрофия ПЖ. Главные легочные артерии расширены, имеет место увеличенный артериальный проток. Легочный венозный возврат обычно происходит в ЛП, но в случае неизмененной предсердной перегородки (в 10% случаев) может быть аномальный легочный венозный возврат. Почти всегда отмечается коарктация аорты.
Патофизиология
Гипоплазия левых отделов сердца (рис. 1) - хороший пример выдающейся адаптивности кровообращения плода, обеспечивающей выживание плода даже при таких сложных пороках. Церебральное и коронарное кровообращение осуществляется ретроградно вокруг дуги аорты через артериальный проток. У приблизительно 30% пациентов описаны врожденные структурные аномалии головного мозга. Постнатально системное кровообращение остается зависимым от проходимости артериального протока. Для поддержания системного кровотока легочный венозный возврат должен происходить в ПЖ (как правило, через предсердную перегородку). Неперфорированная или рестриктивная предсердная перегородка приведет к раннему отеку легких. Соотношение потоков в малом и большом круге зависит от баланса между легочным и системным сосудистым сопротивлением. При сохранении артериального протока открытым, по мере постнатального снижения легочного сосудистого сопротивления, будет увеличиваться ток крови через легкие и снижаться системное кровообращение, что приведет к ацидозу.
Рис. 1. Изображения гипоплазированых левых отделов сердца.
А - вид на четыре камеры через грудную клетку плода, видна гипоплазия левых отделов сердца. ЛЖ визуализируется как маленькая эхогенная область, рядом с расширенным ПЖ.
Б - аксиальное магнитно-резонансное постнатальное изображение ребенка с гипоплазией левых отделов сердца. Маленький гипертрофированный ЛЖ можно наблюдать кзади от формирующего верхушку расширенного ПЖ.
В и Г - 3D-МРТ-реконструкции пациента с гипоплазией левых отделов сердца сразу после первого этапа реконструктивной операции Norwood в модификации Sano. Изображения обозначены цветом, при этом белый цвет отображает ПЖ, голубой - соединение между ПЖ и легочной артерией и ветку легочных артерий, красный - реконструкцию дуги аорты и нисходящей аорты.
В- вид слева, обратите внимания на крохотную восходящую аорту, рядом с гораздо большим ПК, инкорпорированным в реконструкцию дуги аорты.
Г - вид слева, обратите внимание на расположенное спереди соединение между ПЖ и ЛА, которое снабжает ветвь ЛА. H - голова; P - задний; L - левый; F - ноги; A - передний; R - правый.
Диагностика
Клинические проявления
Многим детям диагноз ставится пренатально после проведения ЭхоКГ плода. Это дает возможность оптимизировать постнатальное ведение ребенка и ограничить осложнения. Клинические признаки, описанные ниже, отражают ситуацию, когда диагноз не был поставлен пренатально. Сразу после рождения большинство детей будут чувствовать себя хорошо в том случае, если у них неинтактная или очень рестриктивная предсердная перегородка. Симптомы начинают появляться с закрытием артериального протока, при этом быстро проявляются признаки ОСН с нарастающим цианозом, ацидемией, дыхательными расстройствами. Необходимо своевременно обеспечить респираторную поддержку и инфузию простагландинов для восстановления фетальной модели кровообращения и обеспечения проходимости артериального протока, от которого зависимы такие новорожденные. Данные объективного осмотра включают:
- тахипноэ с диспноэ;
- цианоз с отсутствием пульса на нижних конечностях и бледность;
- гиподинамическую прекардиальную область;
- нормальный I тон, одинарный II и ритм галопа;
- систолический шум изгнания (как правило, мягкий);
- гепатомегалию.
Рентгенография грудной клетки
На рентгенографии определяются кардиомегалия, большая тень ПП, легочный застой/отек легких.
Часто отмечаются правостороннее смещение оси, гипертрофия ПЖ, признаки ишемии миокарда.
ЭхоКГ
В случаях подтвержденного диагноз гипоплазии левых отделов сердца ЭхоКГ должна выявить детали, которые могут повлиять на выживаемость таких младенцев после проведения хирургического вмешательства. У всех пациентов с таким заболеванием систематически должно выполняться:
- подтверждение нормального легочного венозного возврата;
- оценка размеров и характеристик потока через любые предсердные коммуникации;
- оценка функции и состоятельности трикуспидального клапана;
- оценка легочного клапана - исключение значительного стеноза или несостоятельности;
- тщательное определение размеров восходящей аорты и дуги аорты;
- характеристика потока через артериальный проток;
- выявление наличия коарктации аорты;
- оценка функций желудочков.
Катетеризация сердца и ангиография
Диагностическая катетеризация не играет или играет очень маленькую роль в начальном ведении младенцев, которые часто находятся в критическом состоянии. Лечебная катетеризация использовалась как первый этап паллиативного лечения данного порока.
Естественное течение и лечение
Естественное течение этого состояния без вмешательства в раннем постнатальном периоде ведет к смерти в результате закрытия артериального протока, обычно на первой неделе жизни. Появление возможности инфузии простагландинов и развитие стадийности паллиативных манипуляций привело к очевидному изменению прогноза. Но даже при наличии открытого артериального протока, поддерживаемого инфузиями простагландинов, для обеспечения выживаемости таких детей необходимо адекватное и постоянное ведение для предотвращения перегрузки по малому кругу с последующей СН. Постанальное ведение детей с гипоплазией левых отделов сердца можно разделить на активное хирургическое лечение (этапное паллиативное и редко трансплантационное) и "поддерживающий уход", когда активные постнатальные вмешательства не выполняются.
Очень небольшое количество центров предлагают трансплантацию как первоочередной метод лечения, что связано со сложностями в поиске донора, которое ограничивает такой подход. Впервые паллиативные манипуляции были выполнены в 1980-х годах и это привело к стабильному увеличению выживаемости. Первоначальное хирургическое вмешательство (процедура Норвуда) выполняется в неонатальный период и требует рассечения легочного ствола, который анастомозируют с гипоплазированной аортой, которую, в свою очередь, наращивают с помощью гомотрансплантата. Снабжение отсоединенных легочных артерий осуществляется через модифицированный правосторонний шунт Blalock-Taussig или, в последнее время, наложением специального переходника, ограничивающего ПЖ и соединяющий его с ЛА, используя GoreTex® трубку (модификация Sano).
После первой стадии в 4-6 мес следует выполнение верхнего кавопульмонального анастомоза и закрытие этого кавопульмонального соединения в 2-3 года путем создания нижнего кавопульмонального анастомоза. Выживаемость после 1-го этапа в большинстве центров составляет 80-90% и обычно выше для 2-й и 3-й стадий. Успешно применяемый в некоторых центрах комбинированный подход, использующий, как хирургические вмешательства, так и лечебные катетеризации (гибридные процедуры), приводит к сходным результатам. Через срединную стернотомию, выполняется хирургическое билатеральная перевязка ЛА и установка, через затягивающийся шов на ЛА, стента в артериальный проток для обеспечения его проходимости.
При необходимости выполняют рассечение предсердной перегородки. Все это пока не требует обеспечения новорожденному искусственного кровообращения. Вторая стадия является более сложной, так как необходимо провести реконструкцию дуги аорты, удалить стент из протока и наложить верхний кавопульмональный анастомоз.
Согласно всем данным, происходит постепенное потеря пациентов, как между стадиями, так и после третей. Более того, похоже что неврологические результаты у большинства пациентов, леченных по протоколу Норвуда не соответствуют норме.
Долгосрочный прогноз
Лишь некоторые пациенты, которым была выполнена операция Норвуда, в настоящее время дожили до взрослой жизни, но взрослые кардиологи должны осознавать, каких огромных усилий стоило выхаживание этих пациентов в детском возрасте и насколько улучшились ранние результаты. Всем выжившим понадобится длительное наблюдение в специализированных центрах для взрослых с врожденными заболеваниями сердца, так как проблемы могут рецидивировать. У таких больных "пластика единственного желудочка" оставляет последний работать в качестве системного двигателя. Понятно, что скорее всего, будет иметь место постепенное снижение желудочковой функции, что приведет к росту пациентов с признаками недостаточности кровообращения по типу Фонтена.
Долгосрочная стратегия в лечении этой группы пациентов может заключаться в трансплантации сердца, однако ограничением будут предыдущие операции и малое число доноров, что приведет к ситуации, когда лишь некоторые из пациентов смогут ей воспользоваться.
John E. Deanfield, Robert Yates, Folkert J. Meijboom и Barbara J.M. Mulder
Врожденные пороки сердца у детей и взрослых
Гипоплазия левых отделов сердца (СГЛС) представляет собой комплекс врожденных сердечных аномалий, когда левый желудочек слабо развит или отсутствует. При этом ток крови в левом желудочке сильно ограничен из-за левосторонних изменений, таких как стеноз устья аорты с атрезией, стеноз митрального клапана с атрезией.
Гипоплазия левых отделов сердца встречается с частотой 1 на 2500 родившихся. Заболевание занимает 4 место среди сердечных пороков у пациентов первого года жизни. Также СГЛС — это наиболее распространенный порок с вовлечением одного желудочка. На его долю приходится от 1,5 до 4% врожденных пороков и примерно 25% летальных исходов, связанных с врожденными пороками.
Анатомия
Гипоплазия левых отделов сердца классифицируется на 4 вида, основанных на строении митрального и аортального клапанов. Типы СГЛС перечислены по частоте:
- стеноз устья аорты и митрального клапана,
- аортальная и митральная атрезия,
- стеноз устья аорты, митральная атрезия,
- аортальная атрезия и стеноз митрального клапана.
Более тяжелыми формами порока являются те, что включают в себя аортальную атрезию. Они характеризуются малыми размерами левого желудочка или его отсутствием с гипопластической восходящей частью дуги аорты малых размеров (2-3 мм).
Патофизиология
При нормальном развитии плода оксигенация крови происходит в плаценте, и правый желудочек получает 60% объема сердечного выброса через артериальный проток, таким образом, плод развивается нормально. Однако после рождения левый желудочек еще малых размеров или отсутствует и не способен поддерживать кровоток в большом круге. Поэтому кровь, возвращающаяся по легочным венам, оттекает в правое предсердие через открытое овальное отверстие или ДМПП, попадает в правый желудочек. Правый желудочек поддерживает кровоток в большом и малом круге одновременно, причем кровь попадает в большой круг через открытый артериальный проток. Частичное закрытие протока ведет к серьезному ухудшению состояния новорожденного. Полное закрытие протока у новорожденных с СГЛС несовместимо с жизнью. Соотношение тока крови по малому и большому кругу зависит от соотношения системного и легочного сопротивления. В норме легочное сопротивление резко возрастает после рождения, ток крови в большой круг при этом уменьшается. Исследования показывают, что гладкие мышцы легочных артериол более чувствительны к концентрации O2 и уровню pH в артериолах. Таким образом, искусственная вентиляция легких, которая повышает концентрацию O2 и уровень pH, приведет к увеличению объема кровотока по малому кругу и снижение объема кровотока по большому кругу у новорожденных с СГЛС. Если не лечить порок, то новорожденные погибают в течение первых дней жизни и 95% умирают в течение месяца. Встречаются редкие случаи, когда пациенты с СГЛС, ОАП больших размеров и сбалансированным кровотоком между большим и малым кругами доживают до 5-10 лет и умирают от окклюзии легочных сосудов.
Симптомы гипоплазии левых отделов сердца
Развитие заболевания и физикальное исследование
У новорожденных с СГЛС в течение 24 ч после рождения имеется ограниченный кровоток через межпредсердную перегородку. Однако большинство пациентов с нормальными показателями по шкале Апгара спустя несколько дней, когда закрывается проток, начинают проявлять симптомы. Данные, полученные во время врачебного осмотра, неспецифичны, включают в себя расстройства дыхания, тахикардию, тахипноэ, умеренный цианоз и признаки сердечно-сосудистой недостаточности. При пальпации выявляется увеличение границ правого желудочка, и отсутствие пульсации на верхушке левого. Аускультативно выслушивается нормальный первый тон и отдельный интенсивный второй тон.
Диагностика гипоплазии левых отделов сердца
Электрокардиографическое исследование
ЭКГ показывает увеличение правых отделов сердца.
Изобразительные методы исследования
Рентгенография грудной клетки дает неспецифические результаты и может показать кардиомегалию и усиление легочного рисунка. Диагноз подтвеждается с помощью допплер-ЭхоКГ. У большинства пациентов порок выявляется при внутриутробной диагностике с помощью ультразвукового исследования. В катетеризации сердца обычно нет необходимости, тем более что она противопоказана в случаях, когда у новорожденного имеются серьезные заболевания.
Лечение гипоплазии левых отделов сердца
СГЛС не совместим с жизнью, то есть показания к при гипоплазии левых отделов сердца абсолютные. Одни эксперты рекомендуют проводить пересадку сердца, другие советуют производить пошаговые реконструктивные процедуры, изменяющие физиологические механизмы, из-за которых левый желудочек не развивается.
Противопоказаниями к оперативному вмешательству служат тяжелые сопутствующие аномалии, серьезные хромосомные аномалии, слабое функционирование желудочка и персистирующую полиорганную недостаточность, развивающуюся вопреки проводимым реанимационным мероприятиям. Сильная регургитация в трехстворчатом клапане или клапане легочной артерии считается противопоказанием к реконструктивной операции, но не к пересадке сердца.
Техника операции
Наряду с успешным оперативным вмешательством проводится медикаментозное лечение, которое включает введение простагландина E1, для поддержания артериального протока в открытом состоянии, поддержание сбалансированного легочного и системного сопротивления. При этом стараются избегать кислородной терапии и не допускать развития респираторного алкалоза, а также агрессивных реанимационных мероприятий.
Реконструктивные операции проводят в три этапа, описанных Норвудом. Первый этап выполняется в первые 2-3 дня после рождения. Хирургическое вмешательство осуществляется путем срединной стернотомии с использованием сердечно-легочного шунта, холодовой кардиоплегии.
- Первый этап состоит из трех компонентов: предсердная септостомия, чтобы восстановить венозный возврат к правому предсердию; соединение аорты с правым желудочком, используя проксимальную главную легочную артерию, с наложением заплаты на восходящую часть дуги аорты и арку аорты; создание анастомоза из политетрафторэтилена между безымянной артерией и правой легочной артерией, позволяя легочным сосудам нормально расти и развиваться.
- Второй этап называют геми-Фонтена или формирование двунаправленного шунта Гленна. Проводится в возрасте 6 мес. Этап состоит из устранения шунта между большим и малым кругами кровообращения и соединения верхней полой вены с правой легочной артерией.
- Третий этап — операции Фонтена, выполняется в возрасте от 1 до 3 лет, состоит из соединения нижней полой вены с легочной артерией различными методами.
Осложнения и исход гипоплазии левых отделов сердца
После первого этапа операции летальность составляет 25-45%, поздняя — 10-25%. После операции Фонтена эти показатели становятся меньше: 10-15% и 5-10% соответственно. Летальность при трансплантации сердца находится в пределах 20-30%. Многие пациенты умирают, не дождавшись операции, из-за отсутствия доноров. Серьезной проблемой может стать отторжение трансплантата. Таким образом, смертность при трансплантации сердца такая же, как при трехэтапной реконструкции.
Статью подготовил и отредактировал: врач-хирургГипоплазия левых отделов сердца – врожденный порок сердца, который заключается в недоразвитии левого желудочка или его функциональной слабости.
Сокращенная полость левого желудочка и недоразвитие левого предсердия сочетается с пороками митрального и аортального клапанов, с гипоплазией аорты . Среди дефектов клапанов возможны атрезия, гипоплазия и стеноз.
Это достаточно редкий порок, частота которого, по оценкам разных источников, находится в пределах от 1 до 6% в общем числе врожденных пороков сердца. Порок получил название синдром Раухфуса-Киселя. Он является самой распространенной причиной смерти у новорожденных.
Недоразвитости левого желудочка сердца зачастую сопутствуют нарушения в межпредсердной и межжелудочковой перегородках, а также эндокардиальный фиброэластоз.
Часть исследователей считают такой порок наследственной патологией. После рождения первого ребенка с патологией левых отделов сердца риск повторения возрастает до 4%, а после рождения второго такого ребенка – до 25%. Некоторые утверждают, что причиной появления синдрома гипоплазии сердечного отдела является преждевременное закрытие овального окна.
Виды гипоплазии
Порок подразделяют на два вида:
- Характеризуется недоразвитостью левого желудочка и атрезией устья аорты, может дополняться атрезией митрального клапана или стенозом митрального клапана. При этом полость левого желудочка щелевидная (минимальная). Этот вид гипоплазии наиболее тяжелый. Объем полости левого желудочка не превышает 1 мл.
- Характеризуется недоразвитостью левого желудочка, гипоплазией и стенозом устья аорты, дополняется стенозом митрального клапана. При этом недоразвитость полости левого желудочка не так велика. Такой вид порока сопровождается фиброэластозом эндокарда. Он более распространен, чем первый. Объем полости левого желудочка может составлять от 1 до 4,5 мл.
В обоих случаях наблюдается открытый артериальный проток и открытое овальное окно, увеличение правых сегментов сердца, увеличением толщины ствола легочной артерии.
Недоразвитый левый желудочек формируется у плода на задней поверхности сердца, вверху. А правый желудочек формирует верхушку сердца. При таком пороке, наблюдается дефект межжелудочковой перегородки .
Так как левый желудочек не выполняет своей функции, обеспечение кровотока по малому и большому кругам ложится на правый желудочек сердца. Он выполняет двойную нагрузку, прокачивая кровь, как в системный, так и в легочный круг кровообращения. Попасть в большой круг кровь может только по артериальному протоку.
Порок митрального клапана препятствует току крови из левого предсердия. Артериальная кровь движется в открытое овальное окно и правое предсердие. Затем попадает в правый желудочек. В правых сегментах сердца артериальная и венозная кровь из сосудов большого круга кровообращения смешиваются.
Если нет повреждений межжелудочковой перегородки, кровь идет в легочную артерию. Проходя открытый артериальный проток, кровь попадает в нисходящую аорту. В восходящую аорту и в коронарные сосуды небольшое количество артериальной крови поступает ретроградно. Если порок сочетается с дефектом межжелудочковой перегородки, то из правого желудочка кровь движется в легочную артерию и в недоразвитый левый желудочек, затем в аорту.
Диагностика порока
Гипоплазия левых отделов часто определяется до рождения во время ультразвукового исследования сердца – эхокардиографии плода, на 18-20 неделе беременности. Такое исследование чрезвычайно важно. Оно позволяет подготовиться к рождению больного ребенка и после родов быстро отправить его в специализированную клинику. Иногда в случаях персистирования, боталлова протока порок не диагностируется вовремя, не только при внутриутробном развитии плода, но и после рождения. В ближайшее время развития ребенка артериальный проток может закрыться, что грозит смертельным исходом.
Гипоплазия левого желудочка обычно показывает себя сразу после рождения ребенка. Развитие дефекта зависит от скорости закрытия артериального протока. Недостаточность кровообращения сказывается очень тяжело на его состоянии и обычно приводит к летальному исходу в течение нескольких дней.
Признаки порока похожи на респираторный дистресс-синдром, они сходны с признаками поражения центральной нервной системы и шока. У новорожденного наблюдается:
- тяжелая одышка с втяжением уступчивых мест грудной клетки;
- влажные хрипы в легких;
- бледно-серый цвет кожи;
- понижение рефлексов;
- низкая двигательная активность.
Слабый пульс на конечностях сочетается с сильным сердечным толчком. Причем на руках ребенка пульс более слабый, чем на ногах. Прослушивание выявляет тахикардию 160-200 ударов в минуту и приглушенный тон сердца. Данные замеров давления показывают систолическое не более 60-80 мм рт. ст., пульсовое – 20-25 мм рт. ст. У ребенка наблюдается патологическое увеличение размеров печени. У трети детей, родившихся с таким пороком, появляется отечный синдром.

В первые два дня после рождения при циркулировании смешанной крови в большом круге кровообращения цианоз сильно не проявляется. На третьи сутки проявляется значительный цианоз, кожа новорожденного становится серо-голубой.
Если дефект состоит в узости отверстия аортального клапана, цианоз проявляется дифференцировано. Правая сторона тела, шеи и головы сохраняют нормальный цвет, а на левой половине проявляется цианоз. Или он не проявляется на руках, но сильно выражен на ногах в связи с выбросом крови в нисходящую аорту через Боталлов проток.
Диагноз гипоплазии левых отделов сердца подтверждается данными ЭКГ, рентгенографии, двухмерной эхокардиографии, катетеризации.
Способы лечения
Новорожденные с недоразвитием левых сегментов сердца наблюдаются в реанимационном отделении. Задачей врача является недопущение закрытия артериального протока, а также пробы его открытия. Несколько лет назад помощь таким детям была невозможна. Сегодня существуют способы спасения, но риск летального исхода все еще велик. Без хирургического вмешательства помочь ребенку невозможно.
Хирургический способ лечения проходит в несколько этапов.
- Паллиативный. Операция Норвуда, которая должна снизить нагрузку на легочную артерию и обеспечить кровоснабжение аорты. Срок проведения – две первые недели жизни ребенка. Выживаемость детей после операции составляет 75%.
- Проведение операции Гленна, которую назвали двунаправленный кавопульмональный анастомоз. Она состоит в создании дополнительного сообщения верхней полой вены и левой легочной артерии. Ее цель – направить обходным путем легочный кровоток, минуя дефектный отдел сердца. Результатом операции является поток крови в двух направлениях. Операция проводится в возрасте ребенка от 3 до 6 месяцев и считается подготовительной для проведения следующего этапа. Выживаемость после вспомогательной операции составляет 95%.
- Операция Фонтена. Ее целью является разделение двух кругов кровообращения. При этом сердце будет прокачивать кровь к органам и тканям. Но не будет участвовать в накачивании крови в малый легочный круг, туда кровь попадет самостоятельно. Так как на эффективность операции влияет развитость мышечной массы, поэтому ее проводят не ранее, чем ребенок начинает ходить. Выживаемость составляет 90%.
Диагноз гипоплазии левых отделов сердца – тяжелый и неблагоприятный. После проведения трех этапов коррекции дефекта выживают 70% детей. 90% детей с таким пороком умирает в первый месяц жизни.