Як спалити вуглекислий газ? Вуглекислота рідка (СО2, двоокис вуглецю, діоксид вуглецю) Вуглекислота горить чи ні.
Всі ми ще зі шкільної лави знаємо, що вуглекислий газ викидається в атмосферу як продукт життєдіяльності людини та тварини, тобто він є тим, що ми видихаємо. У досить невеликих кількостях він засвоюється рослинами і перетворюється на кисень. Однією з причин глобального потепління є той же вуглекислий газ або іншими словами двоокис вуглецю.
Але не все так погано як здається на перший погляд, адже людство навчилося використовувати його у великій зоні своєї діяльності в благих цілях. Так, наприклад, вуглекислий газ використовується в газованих водах, або в харчовій промисловості його можна зустріти на етикетці під кодом Е290 як консервант. Досить часто діоксид вуглецю виконує роль розпушувача в борошняних виробах, куди він потрапляє під час приготування тіста. Найчастіше вуглекислий газ зберігають у рідкому стані у спеціальних балонах, які використовуються неодноразово та піддаються заправці. Детально про це можна дізнатися на сайті https://wice24.ru/product/uglekislota-co2. Його можна зустріти, як у газоподібному стані, так і у вигляді сухого льоду, але зберігання у зрідженому стані набагато вигідніше.
Біохіміки довели, що добриво повітря вуглецевим газом – дуже добрий засіб для отримання великих урожаїв від різних культур. Ця теорія давно знайшла своє практичне застосування. Так, у Голландії квітникарі ефективно використовують вуглекислий газ для добрива різних кольорів (гербери, тюльпани, троянди) у тепличних умовах. І якщо раніше необхідний клімат створювався методом спалювання природного газу (така технологія була визнана не ефективною та шкідливою для навколишнього середовища), то сьогодні вуглецевий газ потрапляє до рослин по спеціальних трубочках з отворами та використовується у необхідній кількості в основному в зимовий час.
Широке поширення діоксид вуглецю знайшов і в пожежній сфері як заправку вогнегасника. Вуглекислий газ у балончиках знайшов своє застосування в пневматичній зброї, а в авіамоделюванні він є джерелом енергії для двигунів.
У твердому стані CO2 має як згадувалося назва сухого льоду, й у харчової промисловості використовується зберігання продуктів. Варто відзначити, що в порівнянні зі звичайним льодом, сухий лід має ряд переваг, серед яких висока холодопродуктивність (в 2 рази вища за звичайну), і при його випаровуванні не залишається побічних продуктів.
І це далеко не всі області, де ефективно і доцільно використовується вуглекислий газ.
Ключові слова:Де застосовується вуглекислий газ, Використання вуглекислого газу, промисловість, в побуті, заправка балонів, зберігання вуглекислого газу, Е290
Діоксид вуглецю, оксид вуглецю, вуглекислота – усі ці назви однієї речовини, відомої нам як вуглекислий газ. То якими ж властивостями володіє цей газ, і які сфери його застосування?
Вуглекислий газ та його фізичні властивості
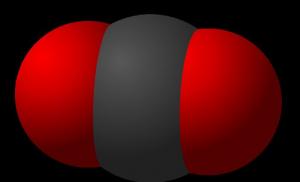
Вуглекислий газ складається з вуглецю та кисню. Формула вуглекислого газу має такий вигляд – CO₂. У природі він утворюється при спалюванні чи гниття органічних речовин. У повітрі та мінеральних джерелах вміст газу також досить великий. крім того люди та тварини також виділяють діоксид вуглецю при видиханні.

Мал. 1. Молекула вуглекислого газу.
Діоксид вуглецю є абсолютно безбарвним газом, його неможливо побачити. Також він не має запаху. Однак при його великій концентрації у людини може розвинутись гіперкапнія, тобто ядуха. Нестача вуглекислого газу також може спричинити проблеми зі здоров'ям. Внаслідок нестачі цього газу може розвинутись зворотний стан до задухи – гіпокапнія.
Якщо помістити вуглекислий газ в умови низької температури, то при -72 градусах він кристалізується і стає схожим на сніг. Тому вуглекислий газ у твердому стані називають "сухий сніг".

Мал. 2. Сухий сніг – вуглекислий газ.
Вуглекислий газ щільніший за повітря в 1,5 рази. Його щільність становить 1,98 кг/м³. Хімічний зв'язок у молекулі вуглекислого газу ковалентний полярний. Полярною вона є через те, що у кисню більше значення електронегативності.
Важливим поняттям щодо речовин є молекулярна і молярна маса. Молярна маса вуглекислого газу дорівнює 44. Це число формується із суми відносних атомних мас атомів, що входять до складу молекули. Значення відносних атомних мас беруться із таблиці Д.І. Менделєєва і округляються до цілих чисел. Відповідно молярна маса CO₂ = 12+2*16.
Щоб обчислити масові частки елементів у вуглекислому газі необхідно слідувати формула розрахунку масових часток кожного хімічного елемента в речовині.
n- Число атомів або молекул.
A r- Відносна атомна маса хімічного елемента.
Mr- Відносна молекулярна маса речовини.
Розрахуємо відносну молекулярну масу вуглекислого газу.
Mr(CO₂) = 14 + 16 * 2 = 44 w(C) = 1 * 12 / 44 = 0,27 або 27 % Так як у формулу вуглекислого газу входить два атоми кисню, то n = 2 w(O) = 2 * 16 / 44 = 0,73 або 73%
Відповідь: w(C) = 0,27 або 27%; w(O) = 0,73 або 73%
Хімічні та біологічні властивості вуглекислого газу
Вуглекислий газ має кислотні властивості, оскільки є кислотним оксидом, і при розчиненні у воді утворює вугільну кислоту:
CO₂+H₂O=H₂CO₃
Вступає в реакцію з лугами, внаслідок чого утворюються карбонати та гідрокарбонати. Цей газ не схильний до горіння. У ньому горять лише деякі активні метали, наприклад, магній.
При нагріванні вуглекислий газ розпадається на чадний газ та кисень:
2CO₃=2CO+O₃.
Як і інші кислотні оксиди, цей газ легко вступає в реакцію з іншими оксидами:
СаO+Co₃=CaCO₃.
Вуглекислий газ входить до складу всіх органічних речовин. Кругообіг цього газу в природі здійснюється за допомогою продуцентів, консументів та редуцентів. У процесі життєдіяльності людина виробляє приблизно 1 кг вуглекислого газу на добу. При вдиху ми отримуємо кисень, однак у цей момент в альвеолах утворюється вуглекислий газ. У цей момент відбувається обмін: кисень потрапляє у кров, а вуглекислий газ виходить назовні.
Одержання вуглекислого газу відбувається під час виробництва алкоголю. Також цей газ є побічним продуктом при отриманні азоту, кисню та аргону. Застосування вуглекислого газу необхідно у харчовій промисловості, де вуглекислий газ виступає як консервант, а також вуглекислий газ у вигляді рідини міститься в вогнегасниках.
Найбільш поширені процеси утворення цієї сполуки - гниття тварин і рослинних останків, горіння різних видів палива, дихання тварин і рослин. Наприклад, одна людина за добу виділяє в атмосферу близько кілограма вуглекислого газу. Оксид та діоксид вуглецю можуть утворюватися і в неживій природі. Вуглекислий газ виділяється при вулканічній діяльності, а також може бути видобутий із мінеральних водних джерел. Вуглекислий газ знаходиться в невеликій кількості та в атмосфері Землі.
Особливості хімічної будови даної сполуки дозволяють їй брати участь у багатьох хімічних реакціях, основою яких є діоксид вуглецю.
Формула
У поєднанні цієї речовини чотиривалентний атом вуглецю утворює лінійний зв'язок із двома молекулами кисню. Зовнішній вигляд такої молекули можна так:

Теорія гібридизації пояснює будову молекули діоксиду вуглецю так: дві існуючі сигма-зв'язки утворені між sp-орбіталями атомів вуглецю та двома 2р-орбіталями кисню; р-орбіталі вуглецю, які не беруть участь у гібридизації, пов'язані у поєднанні з аналогічними орбіталями кисню. У хімічних реакціях вуглекислий газ записується як: CO 2 .
Фізичні властивості
За нормальних умов діоксид вуглецю є безбарвним газом, що не має запаху. Він важчий за повітря, тому вуглекислий газ і може поводитися, як рідина. Наприклад, його можна переливати з однієї ємності до іншої. Ця речовина трохи розчиняється у воді – в одному літрі води при 20 ⁰С розчиняється близько 0,88 л CO 2 . Невелике зниження температури кардинально змінює ситуацію - у тому ж літрі води при 17? С може розчинитися 1,7 л CO 2 . При сильному охолодженні ця речовина осідає у вигляді снігових пластівців - утворюється так званий «сухий лід». Така назва походить від того, що при нормальному тиску речовина, минаючи рідку фазу, одразу перетворюється на газ. Рідкий діоксид вуглецю утворюється при тиску трохи вище 0,6 МПа та при кімнатній температурі.

Хімічні властивості
При взаємодії із сильними окислювачами 4-діоксид вуглецю виявляє окислювальні властивості. Типова реакція цієї взаємодії:
З + СО 2 = 2СО.
Так, за допомогою вугілля діоксид вуглецю відновлюється до своєї двовалентної модифікації – чадного газу.
За нормальних умов вуглекислий газ інертний. Але деякі активні метали можуть у ньому горіти, витягаючи з'єднання кисень і вивільняючи газоподібний вуглець. Типова реакція - горіння магнію:
2Mg+CO2=2MgO+C.
У процесі реакції утворюється оксид магнію та вільний вуглець.

У хімічних сполуках 2 часто проявляє властивості типового кислотного оксиду. Наприклад, він реагує з основами та основними оксидами. Результатом реакції стають солі вугільної кислоти.
Наприклад, реакція сполуки оксиду натрію з вуглекислим газом може бути така:
Na 2 O + CO 2 = Na 2 CO 3;
2NaOH + CO2 = Na2CO3+H2O;
NaOH + CO2 = NaHCO3.
Вугільна кислота та розчин СО 2
Діоксид вуглецю у воді утворює розчин з невеликим ступенем дисоціації. Такий розчин вуглекислого газу називається вугільною кислотою. Вона безбарвна, слабо виражена і має кислуватий смак.
Запис хімічної реакції:
CO2+H2O↔H2CO3.
Рівнавага досить сильно зсунуто вліво - лише близько 1% початкового вуглекислого газу перетворюється на вугільну кислоту. Що температура - тим менше у розчині молекул вугільної кислоти. При кипінні з'єднання вона зникає повністю, розчин розпадається на діоксид вуглецю і воду. Структурна формула вугільної кислоти представлена нижче.

Властивості вугільної кислоти
Вугільна кислота дуже слабка. У розчинах вона розпадається на іони водню Н + та сполуки НСО 3 - . У дуже невеликій кількості утворюються іони 3 - .
Вугільна кислота - двоосновна, тому солі, утворені нею, можуть бути середніми та кислими. Середні солі у російській хімічній традиції називаються карбонатами, а сильні – гідрокарбонатами.
Якісна реакція
Одним із можливих способів виявлення газоподібного діоксиду вуглецю є зміна прозорості вапняного розчину.
Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O.
Цей досвід відомий ще із шкільного курсу хімії. На початку реакції утворюється невелика кількість білого осаду, який згодом зникає під час пропускання через воду вуглекислого газу. Зміна прозорості відбувається тому, що в процесі взаємодії нерозчинна сполука – карбонат кальцію перетворюється на розчинну речовину – гідрокарбонат кальцію. Реакція протікає таким шляхом:
CaCO3+H2O+CO2=Ca(HCO3)2.
Одержання діоксиду вуглецю
Якщо необхідно отримати невелику кількість СО2, можна запустити реакцію соляної кислоти з карбонатом кальцію (мармуром). Хімічний запис цієї взаємодії виглядає так:
CaCO 3 + HCl = CaCl 2 + H 2 O + CO 2 .
Також для цієї мети використовують реакції горіння вуглецевмісних речовин, наприклад ацетилену:
СН 4 + 2О 2 → 2H 2 O + CO 2 -.
Для збору та зберігання отриманої газоподібної речовини використовують апарат Кіппа.
Для потреб промисловості та сільського господарства масштаби одержання діоксиду вуглецю мають бути більшими. Популярним методом такої масштабної реакції є випалювання вапняку, в результаті якого виходить діоксид вуглецю. Формула реакції наведена нижче:
CaCO3 = CaO+CO2.
Застосування діоксиду вуглецю
Харчова промисловість після масштабного одержання "сухого льоду" перейшла на принципово новий метод зберігання продуктів. Він незамінний при виробництві газованих напоїв та мінеральної води. Зміст 2 в напоях надає їм свіжість і помітно збільшує термін зберігання. А карбідизація мінеральних вод дозволяє уникнути затхлості та неприємного смаку.

У кулінарії часто використовують метод погашення лимонної кислоти оцтом. Вуглекислий газ, що виділяється при цьому, надає пишність і легкість кондитерським виробам.
Дане з'єднання часто використовується як харчова добавка, що підвищує термін зберігання харчових продуктах. Згідно з міжнародними нормами класифікації хімічних добавок вмісту в продуктах, проходить під кодом Е 290,
Порошкоподібний вуглекислий газ - одна з найпопулярніших речовин, що входять до складу пожежогасних сумішей. Ця речовина зустрічається і в піні вогнегасників.
Транспортувати та зберігати вуглекислий газ найкраще в металевих балонах. При температурі більше 31⁰С тиск у балоні може досягти критичного і рідкий 2 перейде в надкритичний стан з різким підйомом робочого тиску до 7,35 МПа. Металевий балон витримує внутрішній тиск до 22 МПа, тому діапазон тиску при температурах понад тридцять градусів визнається безпечним.
, двоокис вуглецю , властивості діоксиду вуглецю , одержання діоксиду вуглецю
Він непридатний підтримки життя. Однак саме їм «живляться» рослини, перетворюючи їх на органічні речовини. До того ж, він є своєрідним «ковдрою» Землі. Якщо цей газ раптом зникне з атмосфери, на Землі стане прохолодніше, а дощі практично зникнуть.
«Ковдра Землі»
(двоокис вуглецю, діоксид вуглецю, CO 2) формується при з'єднанні двох елементів: вуглецю та кисню. Він утворюється в процесі спалювання вугілля або вуглеводневих сполук, при ферментації рідин, а також як продукт дихання людей та тварин. У невеликих кількостях він міститься й у атмосфері, звідки він асимілюється рослинами, які, своєю чергою, виробляють кисень.
Вуглекислий газ безбарвний і важчий за повітря. Замерзає при температурі -78.5 ° C з утворенням снігу, що складається з двоокису вуглецю. У вигляді водного розчину він утворює вугільну кислоту, проте вона не має достатньої стабільності для того, щоб її можна було легко ізолювати.
Вуглекислий газ - це "ковдра" Землі. Він легко пропускає ультрафіолетові промені, які обігрівають нашу планету, і відображає інфрачервоні, що випромінюються з її поверхні в космічний простір. І якщо раптом вуглекислий газ зникне з атмосфери, то це насамперед позначиться на кліматі. На Землі стане набагато прохолодніше, дощі будуть дуже рідко. До чого це врешті-решт призведе, здогадатися неважко.
Щоправда, така катастрофа нам поки що не загрожує. Швидше навіть навпаки. Спалювання органічних речовин: нафти, вугілля, природного газу, деревини – поступово збільшує вміст вуглекислого газу в атмосфері. Отже, згодом слід очікувати значного потепління та зволоження земного клімату. До речі, старожили вважають, що вже зараз помітно тепліше, ніж було за часів їхньої молодості.
Двоокис вуглецю випускається рідка низькотемпературна, рідкий високий тискі газоподібна. Її одержують із відкидних газів виробництв аміаку, спиртів, а також на базі спеціального спалювання палива та інших виробництв. Газоподібний двоокис вуглецю - газ без кольору та запаху при температурі 20°З тиску 101,3 кПа (760 мм рт. ст.), щільність - 1,839 кг/м 3 . Рідкий двоокис вуглецю - просто безбарвна рідина без запаху.
Нетоксичний і невибухонебезпечний. При концентраціях більше 5% (92 г/м 3 ) двоокис вуглецю надає шкідливий вплив на здоров'я людини — вона важча за повітря і може накопичуватися в приміщеннях, що слабо провітрюються, у підлоги. При цьому знижується об'ємна частка кисню в повітрі, що може спричинити явище кисневої недостатності та ядухи.
Одержання двоокису вуглецю
У промисловості вуглекислий газ отримують з пічних газів, з продуктів розкладання природних карбонатів(вапняк, доломіт). Суміш газів промивають розчином карбонату калію, який поглинає вуглекислий газ, переходячи до гідрокарбонату. Розчин гідрокарбонату під час нагрівання розкладається, вивільняючи вуглекислоту. При промисловому виробництві газ закачується до балонів.
У лабораторних умовах невеликі кількості одержують взаємодією карбонатів та гідрокарбонатів з кислотаминаприклад мармуру з соляною кислотою.
«Сухий лід» та інші корисні властивості діоксиду вуглецю
У повсякденній практиці вуглекислий газ використовується досить широко. Наприклад, газована водаз добавками ароматних есенцій – чудовий освіжаючий напій. У харчової промисловостідіоксид вуглецю використовується і як консервант - він позначається на упаковці під кодом Е290, а також як розпушувач тесту.
Вуглекислотними вогнегасникамикористуються під час пожеж. Біохіміки знайшли, що удобрення... повітря вуглекислим газомдуже ефективний засіб збільшення врожайності різних культур. Мабуть, таке добриво має єдину, але істотну ваду: застосовувати його можна тільки в оранжереях. На заводах, що виробляють діоксид вуглецю, скраплений газ розфасовують у сталеві балони та відправляють споживачам. Якщо відкрити вентиль, то з отвору із шипінням виривається... сніг. Що за диво?
Все просто пояснюється. Робота, витрачена на стиск газу, виявляється значно меншою за ту, яка потрібна на його розширення. І щоб якось компенсувати дефіцит, що виникає, вуглекислий газ різко охолоджується, перетворюючись на «сухий лід». Він широко використовується для збереження харчових продуктів і перед звичайним льодом має значні переваги: по-перше, «холодопродуктивність» його вдвічі вища на одиницю ваги; по-друге, він випаровується без залишку.
Вуглекислий газ використовується як активне середовище при зварюванню дротом, Так як при температурі дуги вуглекислота розкладається на чадний газ СО і кисень, який, у свою чергу, і входить у взаємодію з рідким металом, окислюючи його.
Вуглекислота в балончиках застосовується в пневматичній зброїі як джерела енергії для двигунівв авіамоделюванні.
Вуглекислий газ безбарвний газ із ледь відчутним запахом не отруйний, важчий за повітря. Вуглекислий газ поширений у природі. Розчиняється у воді, утворюючи вугільну кислоту Н 2 CO 3 надає їй кислий смак. У повітрі міститься близько 0,03% вуглекислого газу. Щільність у 1,524 рази більша за щільність повітря і дорівнює 0,001976 г/см 3 (при нульовій температурі та тиску 101,3 кПа). Потенціал іонізації 14,3В. Хімічна формула – CO2.
У зварювальному виробництві використовується термін «вуглекислий газ»див. У «Правилах пристрою та безпечної експлуатації судин, що працюють під тиском» прийнято термін «вуглекислота», а в - термін «двоокис вуглецю».
Існує безліч способів отримання вуглекислого газу, основні з яких розглянуті у статті.
Щільність двоокису вуглецю залежить від тиску, температури та агрегатного стану, в якому вона знаходиться. При атмосферному тиску та температурі -78,5°С вуглекислий газ, минаючи рідкий стан, перетворюється на білу снігоподібну масу «сухий лід».
Під тиском 528 кПа та при температурі -56,6°С вуглекислота може перебувати у всіх трьох станах (так звана потрійна точка).
Двоокис вуглецю термічно стійка, дисоціює на окис вуглецю і лише за температури вище 2000°С.
Вуглекислий газ – це перший газ, який був описаний як дискретна речовина. У сімнадцятому столітті фламандський хімік Ян Баптист ван Гельмонт (Jan Baptist van Helmont) зауважив, що після спалювання вугілля в закритій посудині маса попелу була набагато меншою від маси вугілля, що спалюється. Він пояснював це тим, що вугілля трансформується на невидиму масу, яку він назвав «газ».
Властивості вуглекислого газу були вивчені набагато пізніше 1750р. шотландським фізиком Джозефом Блеком (Joseph Black).
Він виявив, що вапняк (карбонат кальцію CaCO 3) при нагріванні або взаємодії з кислотами виділяє газ, який він назвав «пов'язане повітря». Виявилося, що «пов'язане повітря» щільніше за повітря і не підтримує горіння.
CaCO 3 + 2HCl = СО 2 + CaCl 2 + H 2 O
Пропускаючи «пов'язане повітря» тобто. вуглекислий газ CO 2 через водний розчин вапна Ca(OH) 2 на дно осаджується карбонат кальцію CaCO 3 . Джозеф Блек використав цей досвід для доказу того, що вуглекислий газ виділяється внаслідок дихання тварин.
CaO + H 2 O = Ca(OH) 2
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
Рідкий двоокис вуглецю безбарвна рідина без запаху, щільність якої сильно змінюється зі зміною температури. Вона існує при кімнатній температурі лише за тиску понад 5,85 МПа. Щільність рідкої вуглекислоти 0771 г/см 3 (20°С). При температурі нижче +11°С вона важча за воду, а вище +11°С - легше.
Питома маса рідкого двоокису вуглецю значно змінюється з температуроютому кількість вуглекислоти визначають і продають по масі. Розчинність води в рідкому двоокисі вуглецю в інтервалі температур 5,8-22,9°С трохи більше 0,05%.
Рідкий двоокис вуглецю перетворюється на газ при підведенні до неї теплоти. За нормальних умов (20°С та 101,3 кПа) при випаровуванні 1 кг рідкої вуглекислоти утворюється 509 л вуглекислого газу. При надмірно швидкому відборі газу, зниженні тиску в балоні та недостатньому підведенні теплоти вуглекислота охолоджується, швидкість її випаровування знижується і при досягненні «потрійної точки» вона перетворюється на сухий лід, який забиває отвір у знижувальному редукторі, і подальший відбір газу припиняється. При нагріванні сухий лід безпосередньо перетворюється на вуглекислий газ, минаючи рідкий стан. Для випаровування сухого льоду необхідно підвести значно більше теплоти, ніж для випаровування рідкого двоокису вуглецю - тому якщо у балоні утворився сухий лід, то він випаровується повільно.
Вперше рідкий двоокис вуглецю отримали 1823 р. Гемфрі Деві(Humphry Davy) та Майкл Фарадей(Michael Faraday).
Тверда двоокис вуглецю «сухий лід», на вигляд нагадує сніг і лід. Вміст вуглекислого газу, що отримується з брикету сухого льоду, високий - 99,93-99,99%. Вміст вологи не більше 0,06-0,13%. Сухий лід, перебуваючи на відкритому повітрі, інтенсивно випаровується, тому для його зберігання та транспортування використовують контейнери. Одержання вуглекислого газу із сухого льоду проводиться у спеціальних випарниках. Твердий двоокис вуглецю (сухий лід), що поставляється за ГОСТ 12162.
Двоокис вуглецю найчастіше застосовують:
- для створення захисного середовища при металах;
- у виробництві газованих напоїв;
- охолодження, заморожування та зберігання харчових продуктів;
- для систем пожежогасіння;
- для чищення поверхонь сухим льодом.
Щільність вуглекислого газу досить висока, що дозволяє забезпечувати захист реакційного простору дуги від зіткнення з газами повітря і попереджає азотування при невеликих витратах вуглекислоти в струмені. Вуглекислий газ є, в процесі зварювання він взаємодіє з металом шва і надає на метал зварювальної ванни окислюючу, а також дію, що навуглерожує.
Раніше перешкодою для застосування вуглекислоти як захисне середовище булиу швах. Пори викликалися кипінням металу, що твердіє, зварювальної ванни від виділення оксису вуглецю (СО) внаслідок недостатньої його розкисленості.
При високих температурах вуглекислий газ дисоціює з утворенням активного вільного, одноатомного кисню:
Окислення металу шва вільним, що виділяється при зварюванні з вуглекислого газу, нейтралізується вмістом додаткової кількості легуючих елементів з великою спорідненістю до кисню, найчастіше кремнієм і марганцем (понад тієї кількості, яка потрібна для легування металу шва) або вводяться в зону зварювання флюсами (зварювання).
Як двоокис, так і окис вуглецю практично не розчиняються у твердому та розплавленому металі. Вільний активний окислює елементи, присутні у зварювальній ванні, залежно від їх спорідненості до кисню та концентрації за рівнянням:
Ме + О = МеО
де Ме - метал (марганець, алюміній чи ін.).
Крім того, і сам вуглекислий газ реагує із цими елементами.
В результаті цих реакцій при зварюванні у вуглекислоті спостерігається значне вигоряння алюмінію, титану та цирконію, і менш інтенсивне - кремнію, марганцю, хрому, ванадію та ін.
Особливо енергійно окислення домішок відбувається при . Це пов'язано з тим, що при зварюванні електродом, що плавиться, взаємодія розплавленого металу з газом відбувається при перебування краплі на кінці електрода і в зварювальній ванні, а при зварюванні електродом, що не плавиться - тільки у ванні. Як відомо, взаємодія газу з металом у дуговому проміжку відбувається значно інтенсивніше внаслідок високої температури та більшої поверхні контактування металу з газом.
Зважаючи на хімічну активність вуглекислого газу по відношенню до вольфраму зварювання в цьому газі ведуть тільки плавиться електродом.
Двоокис вуглецю нетоксичний і невибухонебезпечний. При концентраціях більше 5% (92 г/м 3 ) вуглекислий газ надає шкідливий вплив на здоров'я людини, оскільки вона важча за повітря і може накопичуватися в приміщеннях, що слабо провітрюються, у підлоги. При цьому знижується об'ємна частка кисню в повітрі, що може спричинити явище кисневої недостатності та ядухи. Приміщення, де здійснюється зварювання з використанням вуглекислоти, повинні бути обладнані загальнообмінною припливно-витяжною вентиляцією. Гранично допустима концентрація вуглекислого газу повітря робочої зони 9,2 г/м 3 (0,5%).
Вуглекислий газ поставляється по . Для отримання якісних швів використовують газоподібний і зріджений двоокис вуглецю вищого та першого сортів.
Вуглекислоту транспортують і зберігають у сталевих балонах або цистернах великої ємності в рідкому стані з наступною газифікацією на заводі, з централізованим постачанням зварювальних постів через рампи. У стандартний з водяною ємністю 40 л заливається 25 кг рідкої вуглекислоти, яка за нормального тиску займає 67,5% об'єму балона і дає при випаровуванні 12,5 м 3 вуглекислого газу. У верхній частині балона разом із газоподібною вуглекислотою накопичується повітря. Вода, як важча, ніж рідкий двоокис вуглецю, збирається в нижній частині балона.
Для зниження вологості вуглекислого газу рекомендується встановити балон вентилем вниз та після відстоювання протягом 10...15 хв обережно відкрити вентиль і випустити з балона вологу. Перед зварюванням необхідно з нормально встановленого балона випустити невелику кількість газу, щоб видалити повітря, що потрапило в балон. Частина вологи затримується у вуглекислоті у вигляді водяної пари, що погіршує при зварюванні шва.
При випуску газу з балона внаслідок ефекту дроселювання та поглинання теплоти при випаровуванні рідкого двоокису вуглецю газ значно охолоджується. При інтенсивному відборі газу можлива закупорка редуктора замерзлою вологою, що міститься у вуглекислоті, а також сухим льодом. Щоб уникнути цього при відборі вуглекислого газу перед редуктором, встановлюють підігрівач газу. Остаточне видалення вологи після редуктора проводиться спеціальним осушувачем, наповненим скляною ватою та хлористим кальцієм, силікагелієм, мідним купоросом або іншими поглиначами вологи.
Балон з двоокисом вуглецю пофарбований у чорний колір, з написом жовтими літерами «ВУГЛЕКІСЛОТА».